近日,华东理工大学生物反应器工程国家重点实验室叶邦策教授团队又获重大进展,以“Sirtuin-dependent reversible lysine acetylation of glutamine synthetases reveals an autofeedback loop in nitrogen metabolism”为题,6月1日在线发表于《美国国家科学院院刊》(www.pnas.org/cgi/doi/10.1073/pnas.1525654113),该研究揭示了一种放线菌氮代谢的重要调控机制,这是叶邦策教授团队时隔不到半年再次在PNAS上发表研究论文。
放线菌与人类健康息息相关,临床使用的抗生素约70%是由各种放线菌所产生的,而有些放线菌会对人类构成危害,造成人和动植物病害,如引起结核病的病原菌----结核分枝杆菌。由于氮代谢与放线菌的生长、形态发育、抗生素合成及致病性相关联,一直以来放线菌氮代谢调控研究受到了极大的关注。
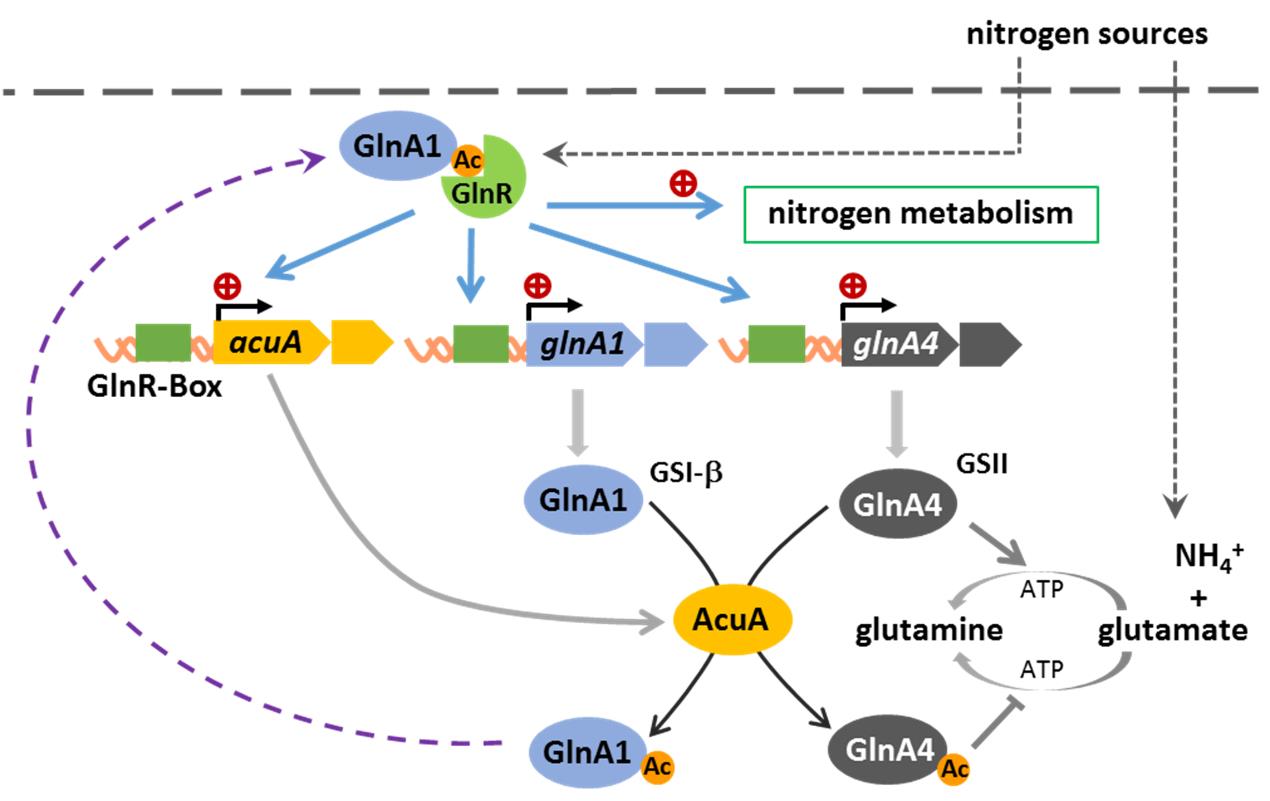
谷氨酰胺合成酶GlnA1是放线菌氮代谢的关键酶,是结核杆菌的毒力因子及药物靶点。课题组首次发现了赖氨酸乙酰化修饰对两种放线菌谷氨酰胺合成酶GSII型及GSI-Beta型具有完全不同的效应:乙酰化抑制了GSII型谷氨酰胺合成酶活性,而乙酰化赋予了GSI-Beta型谷氨酰胺合成酶分子伴侣的调控功能,通过蛋白质-蛋白质相互作用,促进了氮调控因子GlnR 与DNA的结合能力及转录活性 (10)。另一方面,GlnR调控谷氨酰胺合成酶基因转录及谷氨酰胺合成酶乙酰化水平(乙酰转移酶AcuA介导)以响应细胞内可利用氮源的变化。进一步研究发现,这种转录及翻译后修饰氮代谢反馈调控机制(GlnR-PTM-GlnA)在放线菌中是高度保守的,这些发现为工业微生物代谢调控途径的菌种改造及发酵工艺优化提供了理论基础及新策略,也为结核分枝杆菌等致病菌的新药开发提供了新的靶点。
博士生尤迪为论文第一作者,硕士生李志海及青年教师尹斌成等参与了部分研究工作,叶邦策教授为论文通讯作者,该研究得到了国家自然科学基金委重点项目(21335003)及创新群体(21421004)的支持。