作者:阳大海 摄影:阳大海
2017年1月11日,我院刘琴教授课题组在Cell子刊《Cell Host & Microbe》在线发表细菌与宿主互作领域最新研究成果,该论文在杂志网站首页获亮点报道,并由该杂志邀请同行专家发表专文评述(Preview: Manda Yu and Erh-Min Lai. Warfare between host immunity and bacterial weapons. Cell Host & Microbe, 2017, 21: 3-4)。此项工作得到国家自然科学基金重点项目及面上项目的资助,在华东理工大学生物反应器工程国家重点实验室完成。
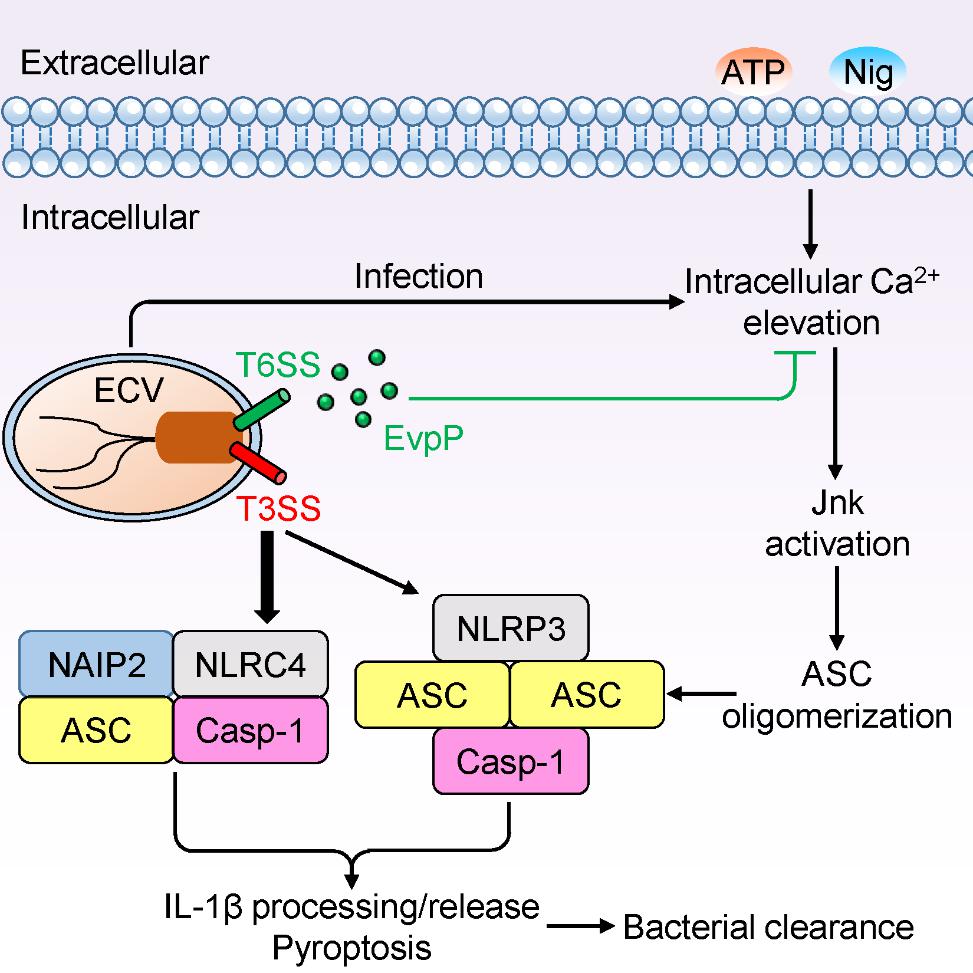
病原细菌与动物和人类宿主的相互作用是一个非常复杂的问题,涉及到病原细菌对宿主的感染和疾病发生,以及宿主对于病原的抑制和清除过程。动物体内固有免疫细胞的细胞质中存在着一种被称为NOD-like receptors (NLRs)的模式识别受体,当NLRs被病原微生物激活后,招募下游ASC接头蛋白和pro-caspase-1,组装成一个蛋白复合物,该蛋白复合物被称为炎症小体(Inflammasome)。在炎症小体内,pro-caspase-1得以活化,导致细胞发生焦亡以及下游促炎性细胞因子IL-1β和IL-18的成熟与分泌,进而清除病原微生物。
刘琴教授课题组发现海洋鱼类病原菌迟缓爱德华氏菌(Edwardsiella tarda)能通过其三型分泌系统(T3SS)激活小鼠巨噬细胞内的NLRC4和NLRP3两种炎症小体。而其六型分泌系统(T6SS)却能够抑制NLRP3炎症小体的激活。课题组进一步鉴定到了一个T6SS效应物EvpP,该效应蛋白能够被T6SS注射到小鼠巨噬细胞内从而介导T6SS对NLRP3炎症小体激活的抑制作用。此外,EvpP也能抑制由三磷酸腺苷(ATP)、尼日利亚菌素(Nigericin)以及单钠尿酸盐晶体(Monosodium urate crystals)所诱导的NLRP3炎症小体的激活。进一步的分子机制研究发现,EvpP能够抑制小鼠巨噬细胞内钙离子浓度的升高,导致下游Jnk信号通路受阻以及后续ASC接头蛋白无法寡聚化,阻断NLRP3炎症小体的激活。体内感染实验表明,EvpP对NLRP3炎症小体激活的抑制作用能帮助促进迟缓爱德华氏菌的体内定植和感染。本论文首次报道一个全新的细菌T6SS效应物EvpP抑制宿主NLRP3炎症小体通路而促进细菌免疫逃逸的机制,上述工作对于深入理解病原菌与宿主的互作机制、指导抗感染药物的理性设计有着重要意义。
该论文研究工作由华东理工大学独立完成,第一作者是博士研究生陈豪,通讯作者是2016年国家自然科学基金委优秀青年计划获得者刘琴教授。
文章在线链接:
http://www.sciencedirect.com/science/article/pii/S1931312816305157
原文摘要:
Inflammasomes are important innate immune defense mechanisms against bacterial infection. Invading bacteria use multiple virulence determinants, typically including effectors of secretion systems to counteract inflammasome activation. So far no type VI secretion system (T6SS) effectors have been reported to inhibit inflammasome signaling. Here, pathogenic bacterium Edwardsiella tarda was demonstrated to activate NLRC4 and NLRP3 inflammasomes via type III secretion system (T3SS) and inhibit NLRP3 inflammasome via T6SS, indicating the antagonistic roles of T3SS and T6SS in inflammasome signaling. Furthermore, a new non-VgrG T6SS effector, EvpP, was identified to significantly inhibit NLRP3 inflammasome activation. Subsequent studies revealed that EvpP significantly suppresses Jnk activation and thus impairs oligomerization of the inflammasome adaptor ASC. Moreover, EvpP counteracts cytoplasmic Ca2+ increase, which works upstream of Jnk activation to regulate NLRP3 inflammasome. Finally, EvpP-mediated inflammasome inhibition promotes bacterial colonization in vivo. This work expands our understanding of bacterial T6SS in counteracting host immune responses.