作者:刘雪婷
近日,我校6165cc金沙总站生物反应器工程国家重点实验室张立新团队刘雪婷课题组在真菌双功能萜合酶的设计改造方面取得新进展,相关工作以“Function Switch of a Fungal Sesterterpene Synthase through Molecular Dynamics Simulation Assisted Alteration of an Aromatic Residue Cluster in the Active Pocket of PfNS”为题发表于Angewandte Chemie International Edition。
萜类化合物是数量庞大的一类天然产物,是天然产物药物研发的重要来源。目前有许多萜类药物应用于临床,例如倍半萜青蒿素、二萜紫杉醇、三萜雷公藤内酯等。其中,目前仅报道了1300余个天然二倍半萜化合物,其结构骨架复杂、生物活性良好,值得深入研究和开发。但萜合酶如何精密调控萜类前体的环系演化规律迄今为止未知。真菌来源的二倍半萜合酶通常含有催化异戊二烯链延伸和环化两个结构域,被统称为双功能萜合酶,目前仅报道了57例,可催化形成了19种不同的结构骨架类型。其催化产物结构骨架的多样性源于双功能萜合酶环化结构域的精密调控,因此,通过改造双功能萜合酶环化结构域,拓展双功能萜合酶的催化功能及其催化产物结构,这对新颖骨架结构二倍半萜类化合物及其生物学功能的研究与开发,具有重要的意义。
张立新团队聚焦“天然药物的高效发现与量产”研究主线,2024年取得了一系列原创性新发现(2024年6月5日在Nat. Biotechnol.长文在线发表血红素及卟啉化合物的高效生物制造;Nat. Prod. Rep. 2024;Trends Biotechnol. 2024;Angew. Chem. 2024)。刘雪婷课题组以“微生物天然药物的高效发现”为研究主线,多年来致力于利用合成生物学策略合成“非天然”的活性天然产物及生物合成关键酶催化机制研究。为了高效挖掘双功能萜合酶的催化功能及其产物结构多样性,课题组选择真菌双功能萜合酶作为研究对象,基于计算化学在萜类骨架的环化反应机制研究方面取得了一定的基础(Org. Lett. 2021, 4645−4650;Chem. Commun. 2022, 9476–9479;Synth. Syst. Biotechnol. 2024, 380−387)。进一步从自主构建的植物内生真菌酶库中选择有改造潜力的萜合酶,采用分子动力学分析比较Type B型双功能二倍半萜合酶PfNS和AcOS的环化结构域,推测双功能二倍半萜合酶的关键功能位点,通过重塑PfNS和AcOS活性口袋的关键芳香族氨基酸簇和酶催化功能验证,取得了以下创新性发现:(1)实现了Type B型5/11二环和5/8/5三环骨架的转换,为揭示萜类环系演化规律提供了重要的理论基础;(2)首次揭示了调控真菌双功能萜合酶催化Type A和Type B型二倍半萜功能转化的关键位点。该工作进一步阐明双功能萜合酶调控碳骨架形成的催化机制,补充完善了萜合酶家族的结构功能关系信息,为利用蛋白质工程改造萜合酶发现新颖萜类天然产物提供了新的思路。
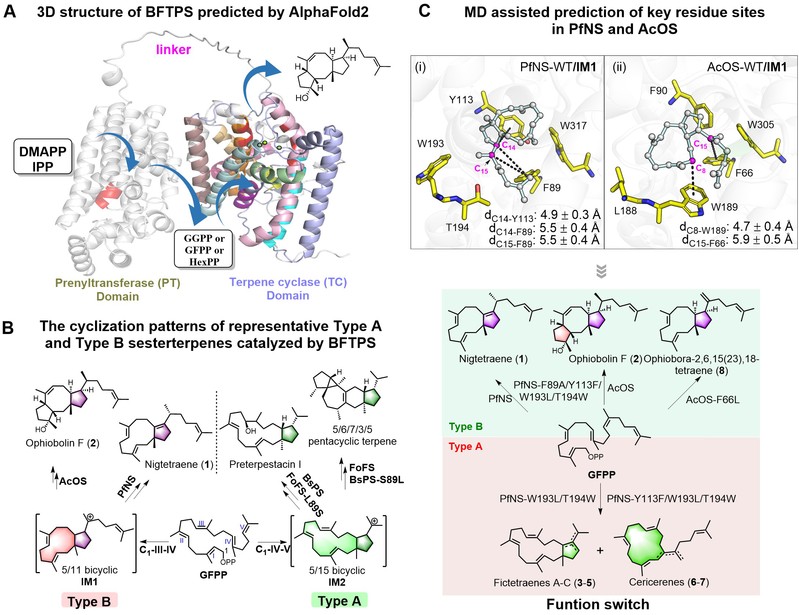
图片说明:真菌来源的双功能萜合酶(A&B)及分子动力学模拟辅助预测萜类环系演化关键氨基酸位点调控PfNS和AcOS催化功能转化(C)
刘雪婷教授和王馨叶博士为该论文的共同通讯作者,博士研究生张维燕为该论文的第一作者。该研究工作得到了张立新教授的长期指导和大力支持、加拿大圭尔夫大学(University of Guelph)Tom Hsiang教授的多年合作和指导、中山大学巫瑞波教授和日本北海道大学(Hokkaido University)Hideaki Oikawa教授的指导,华东理工大学药学院朱彬博士在单晶测试和分析方面提供了帮助。该研究工作得到了国家自然科学基金(21977029, 81903529, 31720103901, 22307037),国家重点研发计划(2020YFA090032 和 2022YFC2105400),中国博士后科学基金项目(2019M661403),111引智计划(B18022),上海市科学技术委员会(21NL2600100),以及生物反应器工程国家重点实验室开放项目基金的资金支持。
原文链接:https://doi.org/10.1002/anie.202406246